新型创新医疗器械中何为软组织诱导性生物材料
以诱导性组织再生材料为核心的新一代生物材料已成为生物材料的发展方向和前沿。 “组织诱导生物材料”(Tissue Inducing Biomaterials)这一颠覆性概念是上世纪由四川大学教授、中国工程院院士、国家工程院外籍院士、中国科学院院士张兴东提出的。世界生物材料科学与工程学会联合会 (1USBSE)。 1990年代提出并证实无生命的生物材料可以通过自我优化设计,在不添加生长因子或药物的情况下诱导活体人体组织或器官的形成。该材料不仅可以诱导骨骼(硬组织)的形成,还可以诱导非骨骼组织(软组织)的形成。该理论已成功应用于韧带、中枢神经、骨骼肌、肌腱、筋膜等软组织的再生,突破了无生命的物质。传统的可诱导活体组织器官再生的理念为新一代生物材料的发展做出了突破性的贡献并获得国际认可,为生物材料的发展开辟了新的视角。
在2018年6月11-12日召开的国际生物材料界第二次定义共识会议上,“组织诱导生物材料”在会议通过后作为新的定义被纳入生物材料的定义.列表。此次获得定义后,将推动组织诱导生物材料相关产品获得FDA(美国食品药品监督管理局)认证,走向更广阔的全球市场。
松散软组织诱导生物材料
软组织诱导生物材料是纤维蛋白原与可降解高分子材料L-丙交酯和己内酯(简称PLCL)共混后的共聚物,具有超亲水性静电纺丝技术制备的可生物降解复合网状支架材料,仿生人细胞外基质,纳米级纤维直径再生膜,呈现完整的三维网状支架结构。

不同放大倍数下扫描电镜放大率的表现:
纤维蛋白原使电纺膜的表面润湿性发生了颠覆性的变化,由原来的超疏水性变为超亲水性,有利于提高材料的生物相容性,调节材料的降解速率,有助于募集、粘附和分化的 局部微环境中的细胞和细胞因子,从而促进组织重塑和再生。通过调整静电纺丝工艺参数,可以调节再生膜的厚度、孔隙率、纤维直径、润湿性等参数,以达到预期的机械强度和降解再生率。材料具有合适的机械强度,降解/再生速率相匹配。静电纺丝技术有利于大规模量产。
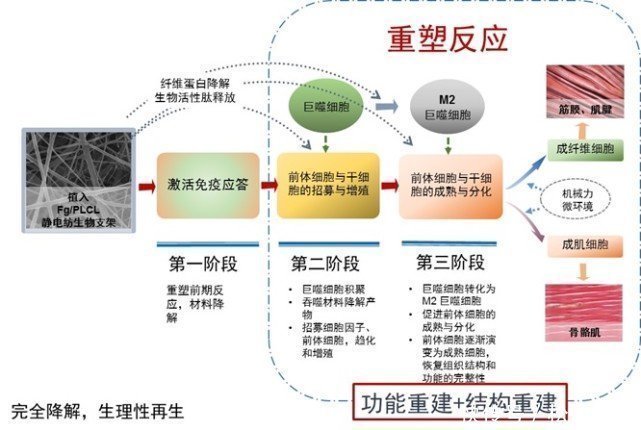
软组织诱导生物材料的作用机制
软组织诱导生物材料植入体内后,会引发重塑反应。纤维蛋白降解刺激受损局部微环境,重新编码伤口愈合过程,引导受损组织停止向纤维化和瘢痕组织发展,促进组织重塑、生理再生,并根据局部负荷的机械力和血供形成差异在微环境中被重塑为具有相应功能的组织结构。
材料以纤维逐渐断裂的方式降解,同时诱导人体自身组织向内生长。在逐层降解的同时,组织进行重塑和再生,从而保证了人体自身的平衡。降解和再生过程中的机械强度。最后,植入物完全降解吸收并被自体组织替代。由于材料具有较大的比表面积和亲水性,有助于伤口愈合因子和细胞的募集、粘附和分化,促进材料的自降解和组织再生,辅助机体修复缺陷组织和恢复。正常的结构和功能。
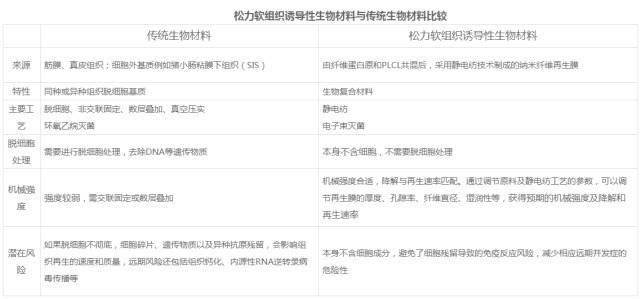
软组织诱导生物材料与传统生物材料的比较
传统生物材料是脱细胞基质。源自动物或人类尸体的贴片,例如猪或牛心包、猪肠粘膜下组织和人真皮组织。由于这些组织含有细胞成分,因此需要进行脱细胞处理,去除各种外源蛋白质、抗原、DNA等,保留具有三维网络结构的细胞外基质。脱细胞后的生物材料机械强度不足,需要采用一定的工艺进行固定和强化,以增加材料的机械强度。根据工艺方法的不同,分为交联固定和非交联固定。交联和固定生物材料通常使用化学或生物交联剂来固定材料。交联固定后,生物材料的机械强度显着增强,但失去了生物材料的特性。严格来说,这种贴片属于生物材料的范畴。 ,自身的特性决定了它在体内更难降解,会像合成材料一样出现异物反应。非交联固定生物材料(如小肠粘膜下组织STS)通常采用多层结构以增加机械强度。例如,采用真空压实法,将4-8层脱细胞材料压制成膜。 ,在压实过程中,材料原有的三维网络支架结构会被破坏,不利于组织再生。
软组织诱导生物材料以纤维蛋白原和PLCL为原料,采用静电纺丝技术制成。它是一种仿生人细胞外基质,呈现出完整的三维网络支架结构。

适用范围
< p>以软组织诱导生物材料为技术平台,制造各种软组织替代品(如血管、腹壁、跟腱、韧带等),以修复身体各部位的软组织。材料植入人体,降解、吸收和重塑,最终再生为人体自身的组织结构。该材料可用于制作一系列组织修复材料,属于Ⅰ、Ⅲ类医疗器械。包括: